公司资讯
文献分享 | 用于精准肿瘤学的肝癌类器官的药物蛋白质组学表征
发布日期:2024-10-11
用于精准肿瘤学的肝癌类器官的药物蛋白质组学表征
一、摘要
类器官模型能模拟亲代肿瘤特性,但肝癌患者的药物反应及精准治疗标志物研究尚不充分。因此,我们创建了LICOB(患者源性肝癌类器官库),结合多组学分析全面描绘肝癌特征。通过蛋白质基因组学分析,确定了与患者预后相关的类器官亚型,高通量药物筛选揭示了反应模式与多组学特征的关联。综合分析药理数据,我们确定了药物反应的分子特征,预测了个性化治疗的药物组合,并在模型中验证了替西罗莫司与乐伐替尼的协同效果。我们还提供了网络门户服务生物医学研究。本研究为肝癌研究提供了重要资源,有望推动精准医学发展。
二、研究结果
1. 类器官概括了原发癌组织的组织学和分子特征
研究者团队利用手术切除的肝癌组织建立了肝癌类器官生物库(LICOB),包含65个类器官,涵盖多种肝癌类型。这些类器官保持了癌症特异性形态和组织学特征,并通过多组学分析(包括RRBS、WES、RNA-seq和无标记蛋白质组学)与亲本组织进行了比较。结果显示,类器官的肿瘤纯度接近100%,基因突变频率、CNV、DNA甲基化、mRNA和蛋白质谱与亲本组织高度一致。在无监督的转录组学分析中,LICOB类器官与肝癌样本和配对组织聚类,而与癌细胞系形成不同聚类,表明LICOB类器官更好地代表了肝癌。高通量药物筛选随后进行,以进一步探索类器官在药物反应和精准治疗中的应用。
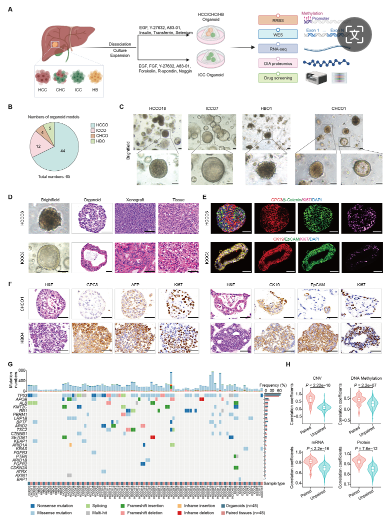
LICOB的建立及与原发性肝癌的比较
2. LICOB 的多组学分类确定了四种亚型
研究者根据五个组学数据集对类器官进行聚类,确定了四种具有不同分子特征的亚型:L-ICC(ICC主导特征)、L-PL(增殖亚型)、L-LM(脂质代谢富集)和L-DM(药物代谢通路富集)。L-PL扩增时间短,CD44上调,预后最差;L-LM表现APOB突变积累,预后最好;L-DM则介于两者之间。利用LICOB聚类的蛋白质组学特征,将CPTAC队列的HCC患者分为三个亚组,结果与LICOB亚型一致,进一步验证了LICOB亚型的预后价值。L-LM中的糖酵解和脂质代谢通路上调,而L-DM中磷酸戊糖和谷胱甘肽代谢不同,可能影响患者预后。
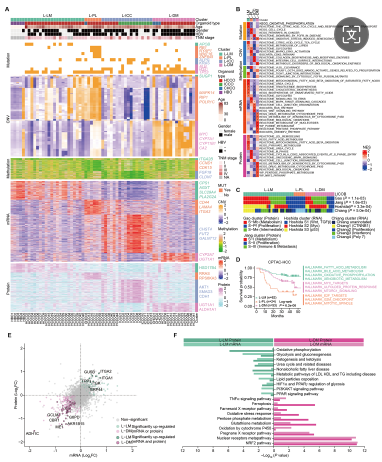
LICOB 的分子亚型
3. G6PD 介导 L-DM 亚型的代谢重编程
研究者对HCC中的可药物靶点进行差异蛋白表达分析,发现G6PD在L-DM亚型中显著上调,且与患者生存率负相关,提示G6PD为促肿瘤因子。G6PD是PPP通路中的限速酶,对氧化还原调节和核苷酸合成至关重要。L-DM中PPP通路增强,而糖酵解下调,G6PD敲除抑制L-DM类器官增殖,降低NADPH和GSH产生,表明G6PD是潜在治疗靶点。L-DM还表现出MYC扩增,与PPP通路蛋白表达正相关,与糖酵解通路蛋白表达负相关。MYC可能通过NRF2激活G6PD转录,支持细胞生长和抗氧化防御。这些结果证实了G6PD的治疗价值,展示了多组学数据驱动治疗发现的潜力。
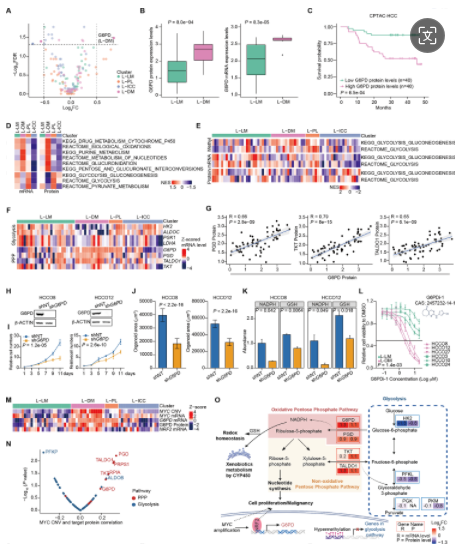
G6PD 作为 L-DM 癌症类器官的潜在药物靶点
4. LICOB 药物反应的异质性与分子亚型相关
研究者使用LICOB队列对76种药物进行了高通量筛选,发现HBV阳性类器官对化疗更耐药。不同LICOB亚型对药物反应模式各异,L-PL对PI3K-AKT-mTOR通路抑制剂敏感,而L-LM和L-DM耐药;L-LM和L-DM对tivantinib敏感,可能与MET激活和功能基因上调有关。L-DM对FGFR抑制剂敏感,而L-ICC类器官对酪氨酸激酶抑制剂耐药,且L-ICC内部药物反应异质,分为R-ICCO和S-ICCO。R-ICCO具有EGFR-TKI耐药特征。总之,LICOB中的药物反应异质性与特定多组学特征相关。
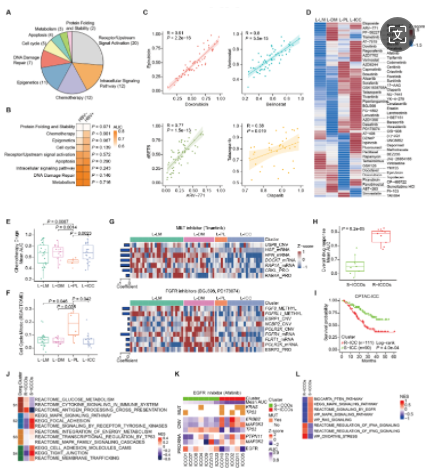
LICOB 类器官中的异质药物反应
5. 利用蛋白质组数据建立药物反应的预测模型
研究者利用多组学数据构建弹性网络回归模型,以识别影响药物反应的分子特征。模型预测肝癌治疗药物的AUC与实测值高度相关,索拉非尼、乐伐替尼和瑞戈非尼的预测效果尤佳。索拉非尼敏感性特征与MYEOV高甲基化、EFNA2等mRNA丰度高及IGF1R蛋白丰度低相关,而耐药特征与酪氨酸激酶等通路富集相关。乐伐替尼耐药则与KRT19等mRNA丰度高及VEGF通路蛋白丰度低相关。这些发现揭示了药物反应与特定分子特征间的关联。
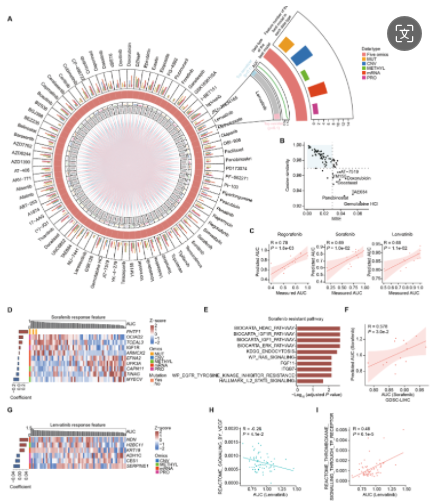
LICOB 中的药物蛋白质组学分析
6. 确定促进乐伐替尼反应的联合方案
研究者利用蛋白质组数据预测LICOB队列中的药物组合。预测显示乐伐替尼与YM155或替西罗莫司组合可能更有效。这些组合通过不同通路相互作用,且对乐伐替尼或替西罗莫司耐药的类器官也对组合敏感。全磷酸化蛋白质组学分析证实了组合的有效性,体外实验和小鼠模型也验证了乐伐替尼与替西罗莫司的协同抑制作用,特别是在乐伐替尼耐药的模型中效果显著。
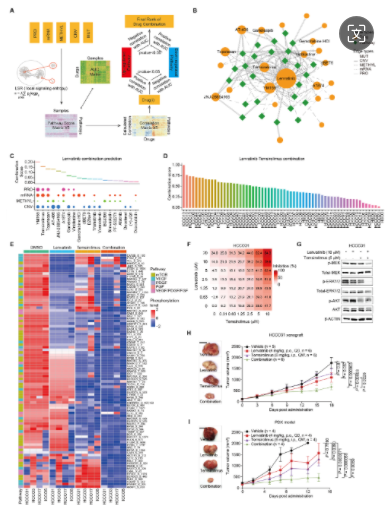
LICOB 中的药物组合预测和验证
三、结论
本研究建立了LICOB,通过多组学分析确定了肝癌的组织学和分子特征,并发现不同亚型的独特药物反应模式。通过综合分析,确定了影响药物反应的分子特征,并预测了个性化药物组合。替西罗莫司和乐伐替尼的协同作用在模型中得到验证。本研究为肝癌研究和精准医学提供了宝贵资源。
参考文献:

更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务~