公司资讯
研究细胞选择性自噬起始的方法
发布日期:2024-09-24
研究细胞选择性自噬起始的方法
一、背景
自噬对细胞内稳态至关重要,但选择性自噬——即针对特定细胞器如线粒体的降解机制尚不明晰。现有研究揭示了自噬小体形成的复杂过程,但底物识别与自噬启动间的联系及靶向特定细胞器的机制仍属未知。特别是,ULK1复合体作为自噬的启动者,其在选择性自噬中的激活方式尚未明确。本文聚焦于选择性自噬形成的早期阶段,探讨这一过程的关键环节。
二、结果
1. 化学诱导蛋白定位法研究NDP52介导的有丝分裂吞噬作用
自噬对细胞内稳态至关重要,但选择性自噬——即针对特定细胞器如线粒体的降解机制尚不明晰。现有研究揭示了自噬小体形成的复杂过程,但底物识别与自噬启动间的联系及靶向特定细胞器的机制仍属未知。特别是,ULK1复合体作为自噬的启动者,其在选择性自噬中的激活方式尚未明确。本文聚焦于选择性自噬形成的早期阶段,探讨这一过程的关键环节。
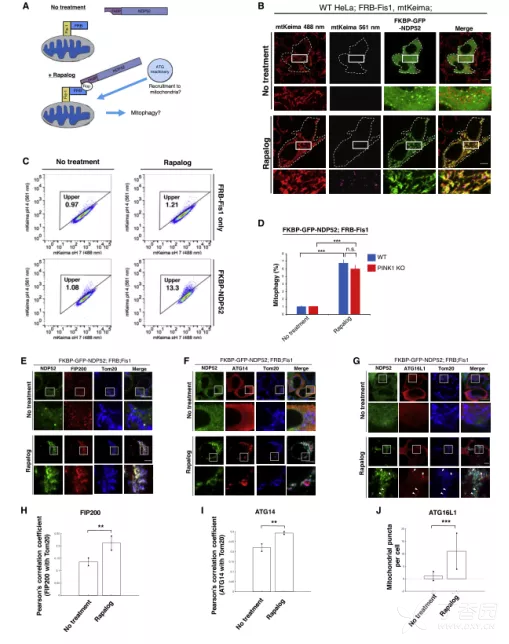
作者通过化学诱导法将NDP52定位到线粒体上,不干扰细胞代谢,成功观察到线粒体溶酶体形成。在PINK1缺失细胞中,NDP52的异位募集仍能诱导线粒体自噬,表明此过程不依赖PINK1/Parkin通路。NDP52定位后招募了包括FIP200、ATG14和ATG16L1在内的ATG蛋白,这些蛋白参与自噬小体成熟,证明NDP52的靶向足以启动选择性自噬。
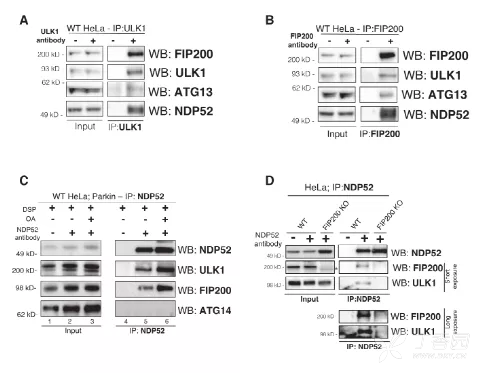
2. NDP52通过FIP200与ULK1复合物相互作用
作者进一步发现,内源性NDP52与ULK1复合物(包括ULK1激酶、ATG13和FIP200)存在结合关系。在Parkin介导的线粒体自噬中,NDP52与ULK1复合物的结合显示出特异性,因为当FIP200缺失时,NDP52无法与ULK1结合,这表明确切的结合路径是NDP52通过FIP200与ULK1复合物相连。
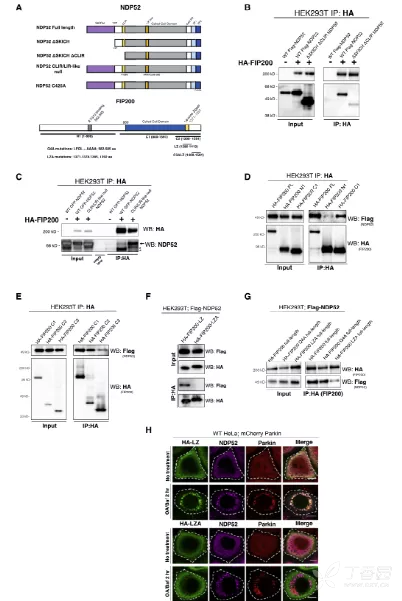
3. NDP52-FIP200相互作用的功能分析
作者通过突变定位实验确认了NDP52与FIP200的相互作用。NDP52的SKICH结构域缺失阻断了其与FIP200的结合,而FIP200的C-末端则被鉴定为与NDP52结合的关键区域。这表明NDP52的SKICH结构域与FIP200的结合对于NDP52诱导的线粒体自噬底物定位至关重要。此外,仅FIP200的C-末端包含亮氨酸拉链结构域的肽段也足以与NDP52结合,进一步证实了这一相互作用的特异性。
4. NDP52介导不依赖LC3的自噬小体发生
现有自噬模型认为自噬受体如NDP52通过泛素和LC3结合促进自噬。但研究发现,LC3非自噬体靶向必需,而对自噬体与溶酶体融合关键。作者提出NDP52等自噬受体在底物上直接启动自噬膜形成,可能是底物识别与自噬起始间的关键。进一步实验显示,将ULK1复合物通过FIP200结合肽定位到底物也能诱导选择性自噬,挑战了传统通过LC3和泛素化降解底物的模型。
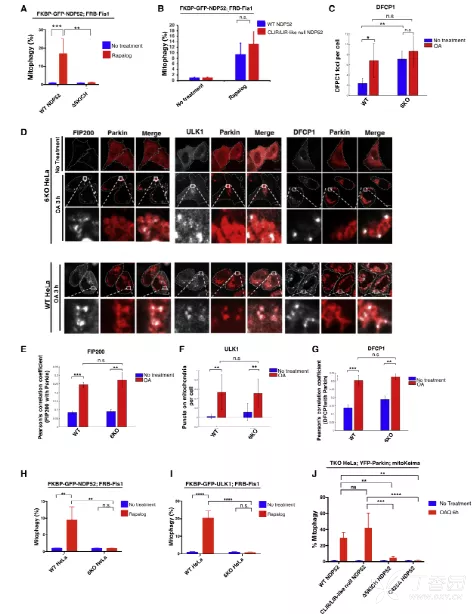
5. ULK1在底物上的异位定位驱动选择性自噬的发生,而不依赖于能量感知途径
作者深入探讨了ULK1在选择性自噬中的激活机制。他们首先排除了AMPK作为ULK1激活因子的可能性,因为AMPK缺失并未影响PINK1/Parkin介导的线粒体自噬。同时,确认ULK1/2激酶活性对于该过程至关重要。进一步,研究发现ULK1在底物上的定位足以启动自噬,且这一过程不依赖于AMPK。
接着,作者考察了mTOR对ULK1的抑制作用。在能量充足时,mTOR磷酸化ULK1以抑制其自噬活性。然而,实验显示,即便在mTOR活跃状态下,通过将ULK1定位至底物也能绕过其抑制作用,启动选择性自噬。
综上所述,作者得出结论:ULK1在底物上的激活是独立于AMPK和mTOR活动的,暗示存在其他未知的激活机制。
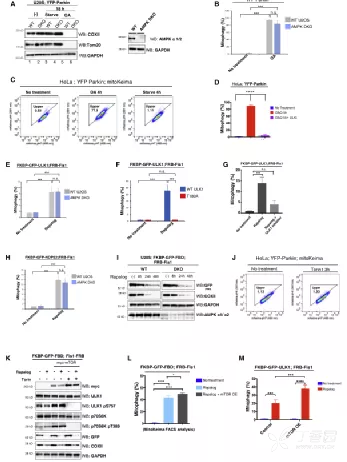
6. TBK1通过促进NDP52-ULK1复合物结合正向调节线粒体自噬
研究表明NDP52诱导线粒体自噬需与FIP200/ULK1复合物互作。TBK1磷酸化NDP52,增强其底物结合和滞留,同时促进NDP52与ULK1复合物结合。TBK1在底物上的定位激活了ULK1的上游,而不受ULK1/2抑制剂影响,说明TBK1在NDP52招募和激活ULK1中起关键作用。
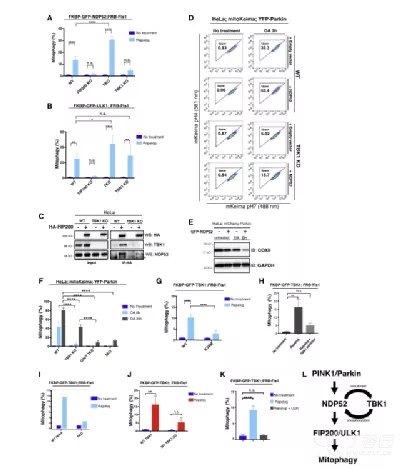
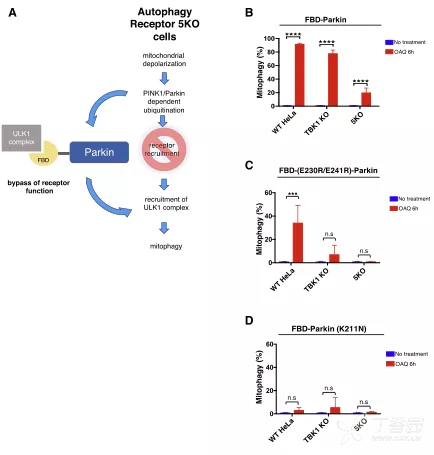
7. 嵌合FBD-Parkin可以补偿线粒体自噬过程中TBK1或受体蛋白的丢失
线粒体损伤激活PINK1/Parkin通路,导致泛素化。但化学诱导法绕过此途径,TBK1和自噬受体对线粒体自噬关键。FBD-Parkin在KO细胞中恢复线粒体自噬,但FBD突变体或线粒体定位缺陷的Parkin突变体则无效。这表明TBK1和NDP52的关键作用是将ULK1复合物导向泛素化底物。
更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务~