公司资讯
细胞稳定转染操作步骤
发布日期:2024-08-29

细胞稳定转染操作步骤
慢病毒转染技术作为细胞稳定转染的有效策略,能精准地将目标基因序列整合至宿主细胞DNA,确保基因在细胞内的持久稳定表达。该技术跨细胞系广泛适用,高效传递基因,并为基因功能深入探索及细胞工程改造提供了不可或缺的基石。
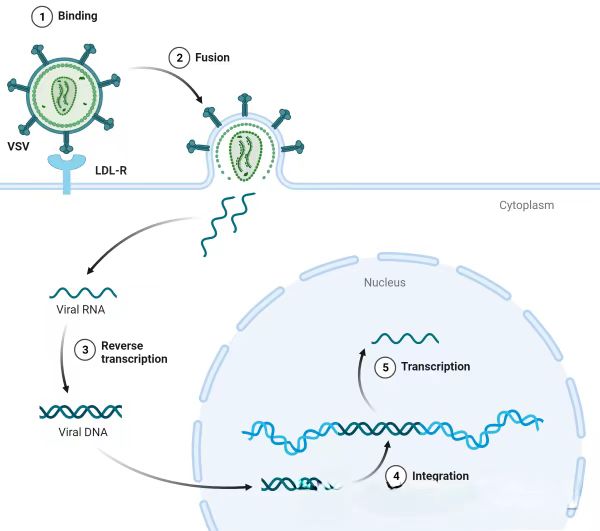
早在1981年,科学家们发现并研究了人类免疫缺陷病毒1型(HIV-1),从而掀开了慢病毒作为载体的研究序幕。慢病毒(Lentivirus)载体是通过对HIV-1进行改造而得到的,其具备感染细胞的能力,包括分裂期和非分裂期细胞,同时在宿主体内能够实现长期表达且具备较高的安全性。这种载体能够稳定表达外源基因,具有广泛的感染范围等优势,因此在基因过表达、RNA干扰、miRNA研究等实验中得到广泛应用。
一、实验步骤
1.提前一天准备细胞
转染前,对293T细胞进行胰酶消化,铺于10厘米培养皿,确保70%-80%贴壁密度。之后,将细胞置于37℃、5% CO2环境孵育8-24小时,待细胞稳固贴壁,即达转染适宜状态,准备进行转染步骤。
2. 转染
(1)转染前,需换液,使用10毫升完全培养基替换旧的培养基。
(2)制备混合物包括包装质粒和目的质粒与转染试剂;
a. 将8µg 目的质粒和16µg 病毒包装质粒(psPAX2:pMD2.G=1:1)加入到1ml 无血清Opti-DMEM,充分混合;
b. 将50µl转染试剂溶于1ml Opti-DMEM中,充分混合,静置5分钟;
c. 将转染试剂稀释后逐滴加入质粒稀释液中,边加边轻搅,室温静置20分钟促DNA与试剂结合成稳定复合物。随后,将此复合物轻柔加入培养皿中,混匀,标记,并重新置于培养箱中继续培养。
(3)经过6~8小时后,吸除培养基,用4ml PBS清洗一次,然后加入8ml 新鲜完全培养基进行培养。
3. 收病毒
转染后,每隔24小时收集培养上清,并标记后更换新培养基。完成所有病毒液收集后,所有接触病毒的器材,如枪头、离心管及培养皿,需用84消毒液彻底浸泡消毒,确保生物安全后,方可按规范程序安全处置,以维护实验室的卫生与安全标准。
4. 包装病毒
贴壁细胞:
(1)在慢病毒转染前夕,预先将贴壁细胞铺板至24孔板,确保各孔细胞密度约为2×10^5个。次日,以含6 μg/ml polybrene的新鲜培养基2毫升替换旧液,并加入适量的病毒悬液,于37℃下共孵育。
(2)针对polybrene敏感的细胞系,转染后迅速以2毫升新鲜培养基稀释,以减少其毒性影响,此操作需在4小时内完成。
(3)维持培养24小时后,更换全新培养基,以去除残留病毒及代谢产物。
(4)继续细胞传代培养,若病毒携带荧光标记,则转染后48小时可见荧光初步显现,至72小时更为显著。若病毒整合有抗性基因,则转染后3-4天可启动药物筛选程序,以筛选稳定转染的细胞株。
悬浮细胞:
(1)将6 μg/ml浓度的polybrene直接融入含2×10^5/ml悬浮细胞的体系中,并添加适量病毒,彻底混匀后,置于37℃环境中孵育。对于难以转染的细胞类型,可选择额外进行室温下的低速离心(150g,持续4小时),以增强转染效率。
(2)针对polybrene敏感细胞,转染操作完成后4小时内,需迅速补充等体积的新鲜培养基,以有效稀释polybrene浓度,减轻其潜在毒性。
(3)继续培养细胞3至4天,期间根据细胞生长状况灵活调整,包括进行必要的细胞传代操作或适时更换新鲜培养基,以确保细胞健康生长及转染效果。
二、注意事项
1、在进行慢病毒实验时,务必遵循安全规范,穿戴实验服、口罩及手套,确保个人防护到位。
2、处理病毒时应极度谨慎,防止气雾或飞溅产生,所有与病毒接触的工具及培养液均需经84消毒液长时间浸泡消毒后,方可安全处置。
3、病毒操作环境应首选生物安全柜,若条件有限使用超净工作台,则需关闭风机以减少风险。
4、若Puromycin处理后细胞死亡率高,应立即更换培养基,避免死细胞释放的毒性物质影响抗性细胞生长。
5、关于病毒液储存,短期内(3天内)可置4℃冰箱暂存;长期保存则需分装至冻存管,-80℃冷冻,标记清晰,密封良好,可保存约6个月。分装时应根据用量精确分配,确保每次使用的便捷与安全。
更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务~