公司资讯
小鼠原位肝移植模型的建立与评价
发布日期:2024-07-26

小鼠原位肝移植模型的建立与评价
小鼠原位肝移植模型

肝脏作为生命基石与免疫调节枢纽,显著提升了肝移植受体的手术耐受力。相较于心脏、肺等异位移植,小鼠原位肝移植模型因高度模拟人类手术,加之其基因组易操作、成本低廉、免疫学监测便捷,成为不可替代的研究工具。自Qian等1991年开创性建立此模型以来,它已深入探索了肝脏的免疫、再生奥秘,并因肝脏的造血功能,为造血系统研究开辟了新径。
一、材料与方法
1. 实验动物
C57BL/6小鼠(供体)与C3H小鼠(受体),均为雄性,年龄介于10至12周之间。
2. 试剂
异氟烷、低分子肝素钠、生理盐水、络合碘、4℃UW威斯康星大学保存液。
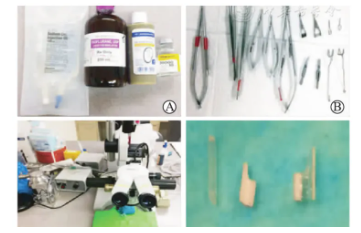
A为实验试剂,B为手术显微器械,C为M650型显微操作系统,D为胆道支架、门静脉袖套和下腔静脉袖套(从左至右)
3. 主要实验器械
显微外科手术器械,包括弯头显微镊、持针器、Weldon小型动脉夹,Johns hopkins动脉夹、显微剪刀等;M650型单人双目手术显微镜;10-0无损伤带线缝合针、7-0丝线,可吸收明胶海绵;手术台、拉钩等自制。
4.手术方法
4.1 术前准备:
(1) 门静脉套管制作:选用18至20号规格的留置针进行加工,套管的主体部分直径约为2毫米,手柄长度则根据操作者习惯设定在1毫米或稍长。为了增强套管的稳固性,防止术中打结不紧密或意外滑脱,需在套管上细心切割出1至2个细微凹槽。
(2) 肝上下腔静脉套管制备:与门静脉套管相似,采用16号留置针作为原材料,按照相同的步骤进行精细加工,确保套管符合手术要求。
(3) 胆道支架的定制:选取PE10聚乙烯管,通过反复的物理拉伸方法,将其直径精确缩小至0.3至0.5毫米之间。随后,对管的两端进行楔形切割,确保切口平滑,支架总长度调整至约2毫米,以满足手术需求。
4.2 供体肝脏获取:
小鼠经气体吸入麻醉后,进行标准术前准备与消毒,固定体位。采用U型或上腹部十字切口充分暴露手术视野。术中,通过精细操作游离肝周组织,依次处理肝动脉、胆道及静脉系统。全身肝素化后,以4℃ UW液缓慢灌注肝脏,直至灌洗液清澈,确保灌注充分。随后,逐一离断关键血管与胆管,摘除胆囊,最终完整取下肝脏。取下的肝脏迅速置于4℃ UW液覆盖的培养皿中,并放置于冰上,以维持最佳状态供后续操作。
4.3 供体肝脏修整:
精确安装20G与16G套管至门静脉与下腔静脉,确保方向无误并避免血管扭曲,随后用10-0丝线稳固结扎。门静脉套管就绪后,追加UW液灌注。在肝下下腔静脉处预置7-0活结,肝上腔静脉则预留10-0带针丝线以备缝合。全程操作均在冰上细致进行,确保肝脏质量。
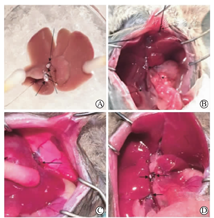
图为小鼠原位肝移植的手术过程 A为休整后的供体肝脏,B为受体肝脏移除前腹腔血管裸化,C为开放后的SHIVC和肝脏,D为手术后的受体腹腔套管情况。
4.4 受体手术:
小鼠麻醉后,备皮消毒并固定,开腹暴露术野,结扎胆管、肝动脉等,分离肝周韧带并牵引SHIVC。补液后,依次阻断并离断IHIVC、PV及SHIVC,移取肝脏。采用外翻吻合SHIVC,袖套法吻合门静脉,开放血管结束无肝期。复温后红润,同法吻合IHIVC,置入胆管支架并固定,还纳肠道,补充生理盐水后缝合关腹。
4.5 术后护理:
术后小鼠被置于37℃恒温环境中,直至其自然苏醒,随后恢复自由饮食与饮水,采取单笼饲养。术后三天内,每12小时通过腹腔注射给予布洛芬(剂量0.1 mg/kg)以缓解疼痛,同时每24小时注射头孢唑林(剂量100 mg/kg)预防感染,无需额外使用免疫抑制剂。
4.6 术后监测:
术后观察小鼠活动情况,存活4天以上判为手术成功。
5. 统计学处理
采用SPSS (16.0版)软件将数据进行统计学处理。计数资料以率(百分比)表示,计量资料以(X±s)表示。
二、结果
1. 预实验
在完成70例小鼠原位肝移植练习中,旨在提升显微外科血管与胆道吻合技巧。初期模型构建时,受体小鼠的死亡主要归因于麻醉并发症、吻合口渗血、血管堵塞、气胸形成、胆瘘导致的腹腔感染,以及门静脉套管的不当操作如扭转等。
2. 移植结果
同系移植220对,成功199对,成功率90.4%。供受体处理时间分别为(40±8.8) min和(75±9.6) min,供肝处理时间(23±4.7) min。失败21例中,原因包括套管扭转、吻合口出血、无肝期过长、胆瘘感染及不明原因,分别导致术后不同时间内的死亡。
三、注意事项
1. 小鼠重量选择
25-30g小鼠最佳,体重过轻胆管细(<25g)、血管短,手术难;过重则脂肪多,易出血,手术难(>35g)。
2、胆管支架制备
避免频繁牵拉导致管腔变窄,影响胆汁流通;同时,支架两端应保持圆润,预防在套管过程中损伤胆管壁。
3、气胸
在进行SHIVC套线时,应先用棉签进行钝性分离,随后用钝镊从左向右下方轻轻分离,确保不误入胸腔。由于小鼠膈肌非常薄弱,若使用暴力牵拉2-0丝线来阻断SHIVC,可能引发气胸甚至心脏骤停的风险。
4、出血及血栓
小鼠肝脏非常脆弱,操作时必须谨慎避免机械性伤害,以防肝脏表面出血。翻动时应轻柔且避免反复,以减少微血栓形成的风险。推荐顺时针方向进行分离,这样可以最大限度地保护肝脏免受损伤。
5、套管扭转成角
门静脉及下腔静脉套管时,肝脏脏面朝上浸于冷UW液,借浮力辨血管。肝横轴与文氏钳平行,血管定位精准:脾、幽门静脉对PV套管6点、3点;右、左肾静脉对IHIVC套管9点、3点。注意肝位,套管时明确血管方向。
6、补液
小鼠的血容量仅1.5~1.8 ml,因此操作时应尽量避免出血,积极止血。无肝期前后补液及术后保温对小鼠术后恢复有重要作用。
7、无肝期
血流阻断应严格限时,不超过20分钟,以防小鼠遭受过度缺血再灌注损伤,导致体内环境紊乱及酸中毒等严重后果。
8、SHIVC缝合
小鼠SHIVC管壁脆弱,肝脏娇嫩,手术要求精细操作。推荐连续外翻缝合法,确保吻合口平滑,预防血栓形成。左膈静脉需单独缝扎,并在3点和9点加强缝合以防漏血。注意避免拉线过紧,以免吻合口狭窄。
更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务~