公司资讯
急性肺损伤模型
发布日期:2024-11-20
急性肺损伤模型
一、前言
研究呼吸系统疾病时,动物模型至关重要。急性肺损伤(ALI)病理生理复杂,模拟其变化是研究治疗的基础。脂多糖(LPS)能诱发小鼠急性肺炎,常用制作ALI小鼠模型。腹腔注射创伤小但靶向性差,气管给药有多种方式。其中,经口气管插管无创、快速、成模稳定,是建造小鼠ALI模型的有效方法。
二、小鼠肺部图
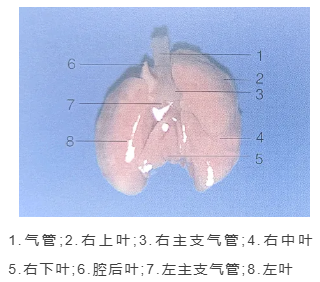
三、器械材料
(1)仪器:显微镜,血生化仪,酶标仪,吸入麻醉系统。
(2)器械材料:眼科镊,1mL 注射器,18 G平头针头,100 μL 平头微量注射器LED 体外透照灯,小鼠悬挂固定器(图47.3),异氟烷,脂多糖(用生理盐水配制成0.5 mg/mL 的溶液)。
四、手术流程
(1)按照小鼠体重,准备好装有脂多糖溶液的 100μL 平头微量注射器,吸入剂量为 1mL/kg。先吸入 20 μL 空气,再吸入脂多糖溶液,针头向下放置待用。
(2)小鼠以 3%异氟烷吸入麻醉
(3)达到较深度麻醉后,迅速将小鼠从麻醉箱中取出,将上门齿固定在小鼠悬挂固定器上,并将光源对准小鼠颈部。
(4)用眼科镊拉出舌头,探视咽喉部,在光源照射下小鼠气管开口处为一亮点,且随着小鼠呼吸会横向开合,若观察不到亮点可调整视线角度,直至看到开合的气管开口便可进行下一步操作。
(5)经口将100μL平头微量注射器针头插入气管,针顶端停止在透光亮点处,快速注入注射器里的全部脂多糖溶液和空气。
(6)从固定器上摘下小鼠,保持竖直状态,轻轻左右摇晃20s,使液体从气管、支气管深入肺部,此时小鼠苏醒。
(7)转入饲养笼内饲养
五、模型评估
1.细胞计数
(1)分离颈前组织,暴露气管。
(2)小鼠安乐死后,立即经口插入 18 G平头针头注射器至气管,距离门齿2cm 处固定。
(3)用37℃的3mLPBS缓冲液分3次全肺灌洗,每次冲洗3遍并回收液体计数细胞。诱导后,小鼠BALF中白细胞数量先降后升,4小时达峰值,之后逐渐下降。
2.细胞因子检测
ALI由非心源性因素引发,特征为肺细胞损伤、炎症及中性粒细胞积聚。ELISA检测BALF中IL-6和TNF-α显示,两者水平诱导后2小时达峰值,随后波动变化。
3. 直接观察
肉眼观察可见诱导后小鼠出现较为明显的肺水肿及肺淤血,正常对照组给予等量生理盐水灌注无明显变化。
4.组织病理学评价
于诱导后不同时间点安乐死小鼠,取肺组织做大体拍照,并做病理切片后行 H-E 染色,观察肺损伤情况。结果发现模型组可见肺泡内出血、炎症浸润、肺组织水肿
5.肺湿干比
术后6小时安乐死小鼠,取肺组织称重得肺湿重,烘干后称重得肺干重,计算湿干比。急性肺损伤会导致湿重和湿干比增加。
6.肺通透性检测
肺损伤给药6小时后,注射伊文思蓝染料。30分钟后取血清和双肺,肺组织匀浆后以甲酰胺孵育,离心取上清液,测量EB浓度并校正血清含量。
六、讨论
1.准确气管插管这一关键操作技术需要注意的事项
(1)用微量注射器吸取诱导药物前可吸入20L空气,药物注射完成后继续推注空气,使诱导药物更加深入肺组织,保证诱导效果。
(2)务必在亮点处插入微量注射器,插入后可明显感触到气管的环状结构,如插到气管外,需更换动物进行诱导。
(3)注入诱导液体后,将小鼠以竖直状态左右轻摇 20s,目的是避免诱导液体随呼吸排出气管,影响诱导效果
2.容易发生的错误以及预防和挽救措施
(1)用眼科镊夹舌头时注意用力不要太大,避免造成舌面破损出血,影响细胞计数和细胞因子检测。
(2)采用吸入麻醉,小鼠在离开麻醉气体后会很快苏醒,故诱导操作务必迅速,不宜超过 30s。为避免苏醒后重新麻醉,必须熟练操作。
参考书籍:《Perry小鼠实验手术造模》
更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务