公司资讯
工程化细菌检测肿瘤DNA
发布日期:2024-10-08
工程化细菌检测肿瘤DNA
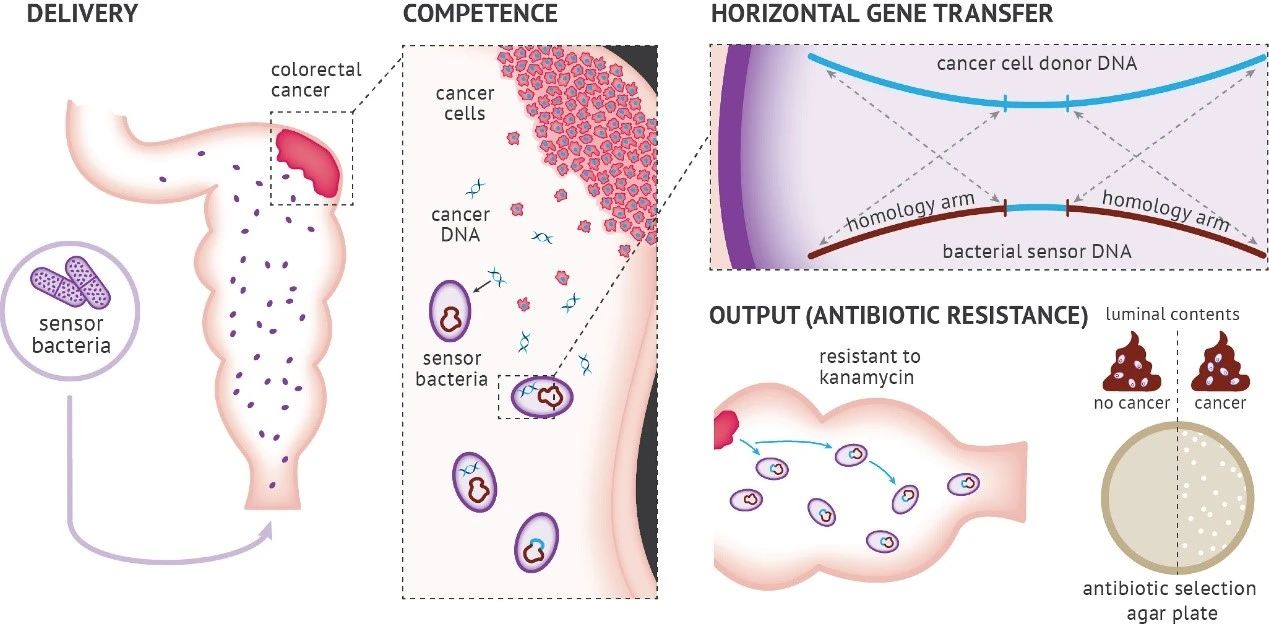
细菌工程助力活细胞诊疗,尤其在肠道与肿瘤检测上。细菌遍布肠道,活动可粪便尿液查。细胞记忆技术让细菌记时间。部分细菌能自然获DNA,即水平基因转移。但用此技术检哺乳动物DNA的细菌工程尚未有。今天解读加州大学圣地亚哥分校Jeff Hasty团队在《Science》的研究,他们创建了用工程化细菌捕捉肿瘤DNA的检测器,名为“CATCH”。
一、改造癌细胞系、类器官和传感细菌
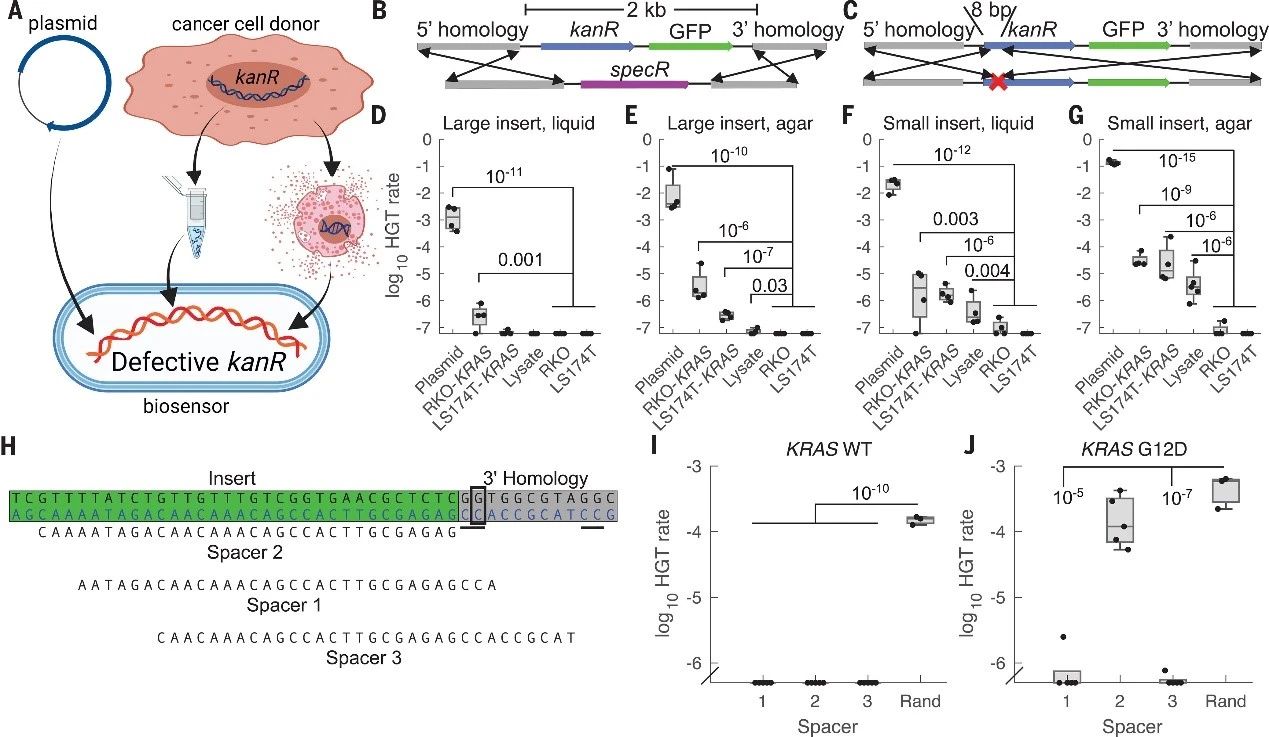
为了验证细菌能否检测特定的哺乳动物DNA(如KRAS癌基因),研究者们首先创建了转基因的人类癌细胞,这些细胞中的KRAS同源臂被插入了卡那霉素抗性基因(kanR)。接着,他们构建了传感器细菌,方法是将包含KRAS同源臂互补序列的片段整合到巴氏不动杆菌中。为了评估传感器细菌是否通过水平基因转移(HGT)从癌细胞中获取了DNA,研究者们通过观察细菌对卡那霉素的抗性程度来进行量化。实验中,他们采用了两种设计:“大插入”设计,需要转移一个2kb的供体盒以获得抗性;以及“小插入”设计,仅需转移8个碱基对(bp)来修复两个终止密码子。
二、检测癌细胞系中的游离DNA
作者用不同来源的DNA在两种培养基上测试了两种设计:“大插入”和“小插入”。在两种培养基上,“大插入”均能检测纯化的质粒和基因组DNA,且在固体培养基上还能检测未纯化的裂解物。而“小插入”效率更高,能可靠检测原始裂解物。固体培养基上的检测更灵敏。实验表明,生物传感器无需DNA纯化。针对KRAS密码子12的常见突变(占CRC KRAS突变的72%),研究者利用巴氏不动杆菌的CRISPR-Cas系统验证了传感器能否区分野生型和突变型KRAS。通过将kanR-GFP整合至供体细胞系的KRAS序列中,并设计CRISPR spacer,传感器细菌能排除野生型KRAS,仅允许KRASG12D整合。实验证明,传感器细菌能单碱基特异性检测KRAS中的突变热点。
三、检测肿瘤类器官的细胞游离DNA
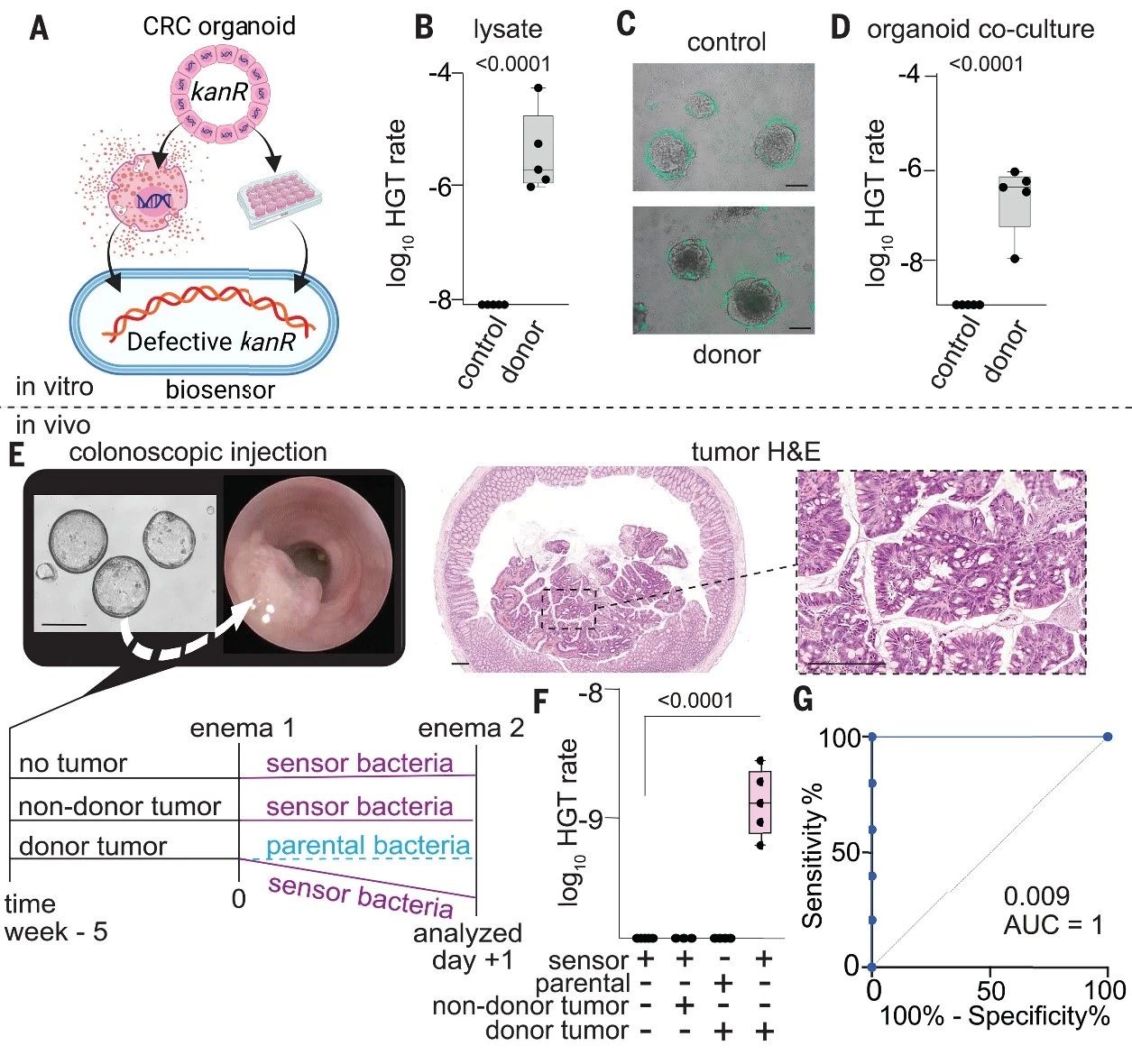
作者接着在类器官培养中评估了传感器和供体。使用Braf等基因突变的BTRZI小鼠类器官(可重现CRC),将供体DNA转导入类器官,再用“小插入”设计的生物传感器检测。通过qPCR确认类器官仅含少量目标DNA拷贝。传感器能从供体类器官裂解液中获取DNA,但不能从亲本类器官中获取。与供体类器官共培养的传感器细菌通过水平基因转移获得了供体DNA。此外,研究人员还估算了传感器在粪便中检测目标DNA的灵敏度,发现检测限为3 pg质粒或约2.7 × 10^5个DNA拷贝。
四、检测结直肠癌原位小鼠模型中的肿瘤细胞游离DNA
作者在体内测试了CATCH系统。首先,通过小鼠结肠镜检查将CRC类器官注射到小鼠结肠中形成肿瘤,并确认肿瘤DNA可释放至结直肠腔。接着,在免疫缺陷小鼠中进行原位CRC实验,将供体或非供体类器官注射至小鼠体内,待肿瘤长入管腔后,通过直肠灌肠给予工程化细菌。分析结果显示,仅在移植了传感器细菌的荷瘤供体小鼠中检测到从肿瘤到细菌的水平基因转移。通过多种方法确认抗性菌落为工程生物传感器菌株。因此,CATCH在实验模型中成功区分了结直肠癌小鼠与健康小鼠。
五、检测非工程基因
最后,作者设计了活体生物传感器来检测非工程化癌症DNA。在传感器中,tetR阻遏基因插入KRAS同源臂间,输出基因受P_LtetO-1启动子控制并被抑制。与KRAS靶DNA重组后,tetR被删除,若KRAS G12位点野生,则被CRISPR-Cas降解;若突变,则输出基因表达。体外测试显示,该传感器能准确检测LS174T细胞的KRASG12D DNA序列,证明了其识别天然目标DNA的能力。
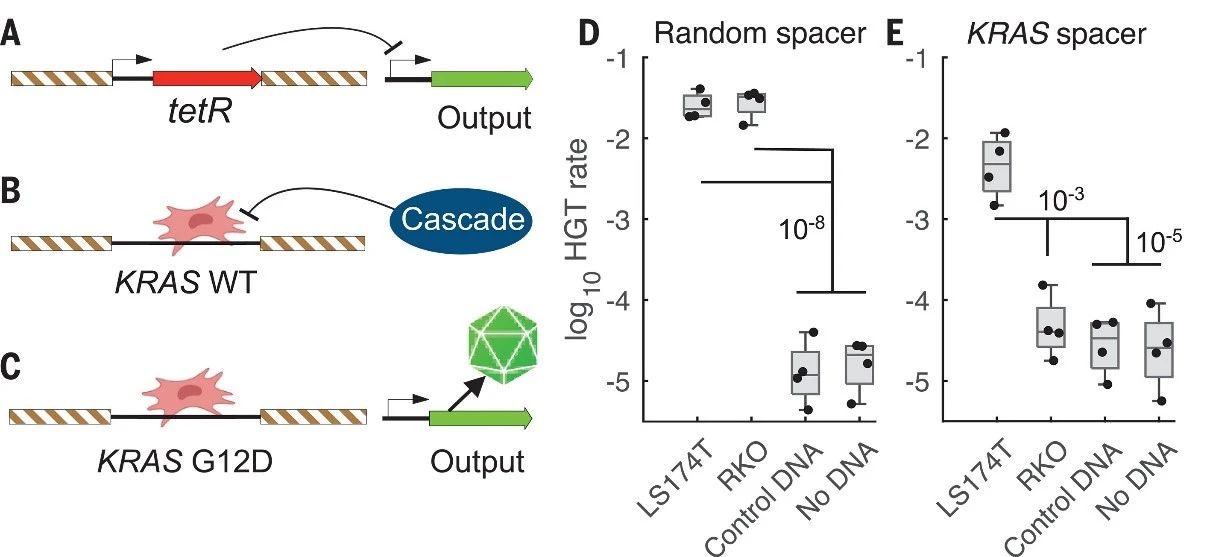
综上所述,该研究创造了一种活体生物传感器,能无需预处理即检测肠道中CRC脱落的特定哺乳动物DNA。该传感器设计模块化,易于调整以检测不同目标序列。然而,该技术尚未达到临床应用阶段,需进一步开发以确保口服给药、足够管腔密度、无创采样检测及生物安全性,同时降低抗生素耐药性风险。
更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务~