公司资讯
有关动脉粥样硬化、ApoE KO小鼠和Ldlr KO小鼠的那些事儿~
发布日期:2024-08-01

揭秘动脉粥样硬化,
看ApoE KO与Ldlr KO小鼠
如何成为科研先锋,
引领我们深入了解这一健康挑战!
动脉粥样硬化,心脏与大脑健康的隐形威胁,源于脂质代谢失衡。它悄然始于动脉内膜,脂质与糖类沉积,伴随出血与血栓,纤维增生与钙质沉积接踵而至。这一过程使动脉壁增厚变硬,管腔狭窄,最终影响血液流通。大中动脉尤易受累,若血流受阻,则器官缺血受损。因其黄色粥样外观,得名动脉粥样硬化。
动脉粥样硬化的形成过程可精炼为3大阶段:
脂质积聚:首先,动脉壁内发生脂质,特别是游离胆固醇和胆固醇酯的积聚,这是动脉粥样硬化病变的起始步骤。
细胞增殖与反应:随后,平滑肌细胞和单核细胞(可能伴随淋巴细胞)在病变区域增生,这些细胞对脂质积聚作出反应,进一步加剧病变过程。
结缔组织生成:在细胞增殖的同时,平滑肌细胞开始合成并分泌关键的结缔组织成分,如弹性纤维蛋白、胶原纤维蛋白和蛋白多糖,这些成分的沉积与积累导致动脉壁结构发生改变,形成纤维斑块,最终造成动脉管腔狭窄。
ApoE KO小鼠和Ldlr KO小鼠:
ApoE(载脂蛋白E)是一种关键的脂肪运载蛋白,作为乳糜微粒和中密度脂蛋白(IDL)的组成部分,它肩负着运输脂蛋白、脂溶性维生素以及胆固醇的重任。ApoE基因精准定位于第7号染色体上,其结构包含七个重要的外显子区域,这些外显子共同调控着ApoE蛋白的功能与表达。
ApoE小鼠模型展现出显著的高血脂特征,早期即现动脉脂肪沉积,晚期脑内形成脂瘤性纤维瘤,伴随学习记忆减退。该模型与多种疾病相关,如CHD、高脂血症、脑梗、AD及乙肝。它是研究ApoE基因与糖尿病、肥胖、心血管健康、动脉粥样硬化及新陈代谢间复杂联系的理想工具。

低密度脂蛋白受体(LDLR)是调控低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)进入细胞的关键,对维持脂蛋白平衡至关重要。其缺失会干扰脂蛋白的正常摄取与清除过程。值得注意的是,即便在标准饮食条件下,小鼠血浆中LDL胆固醇水平仍可显著升高。然而,在缺乏高脂饮食刺激时,Ldlr基因缺陷小鼠的动脉斑块形成相对有限;要达到显著的斑块病变效果,往往需要辅以高脂高胆固醇的饮食条件。
Ldlr小鼠血清胆固醇远超野生型,可达2至4倍。高脂饮食进一步加剧其代谢异常,诱发肥胖、高胆固醇、高甘油三酯及胰岛素抵抗,模拟人类NASH病变。此模型广泛用于糖尿病、肥胖及高脂诱导NASH等代谢疾病的研究,具有重要科研价值。
1. ApoE和Ldlr小鼠模型是动脉粥样硬化研究中的两大主力军,它们虽均能诱导高胆固醇血症,但脂蛋白特性及促进动脉粥样硬化的机制各异,为研究基因产物与细胞类型在其中的作用提供了独特视角。
2. 传统上,动脉粥样硬化研究往往局限于单一模型与性别,以探讨特定基因产物的效应,这种局限性可能影响结论的全面性。
3. 跨模型基因操作研究显示,尽管有时能在ApoE与Ldlr模型中观察到相似效果,但更多情况下,同一操作在两者间产生截然不同的结果,且性别差异亦不容忽视。
4. 理想的研究设计应涵盖在同一饲养环境中,对两种小鼠模型实施相同基因操作,并严格控制饲喂条件与血浆胆固醇水平,同时在雄性与雌性小鼠的动脉多处及病变各阶段进行广泛采样,以确保结果的全面性与准确性。
基因操作对两种小鼠模型
动脉粥样硬化病变区域的影响

大鼠动脉粥样硬化模型:
Ldlr与ApoE小鼠为动脉粥样硬化经典模型,但大鼠难成典型病变。张等人利用CRISPR/Cas9技术创建ApoE/Ldlr单双KO大鼠模型,发现基因敲除致血脂异常、肝脂肪变性,且正常饮食下48周即现腹主动脉斑块,伴单核细胞浸润、炎症因子表达增及巨噬细胞积聚,揭示单核细胞转运与内皮炎症在动脉粥样硬化中的关键作用。
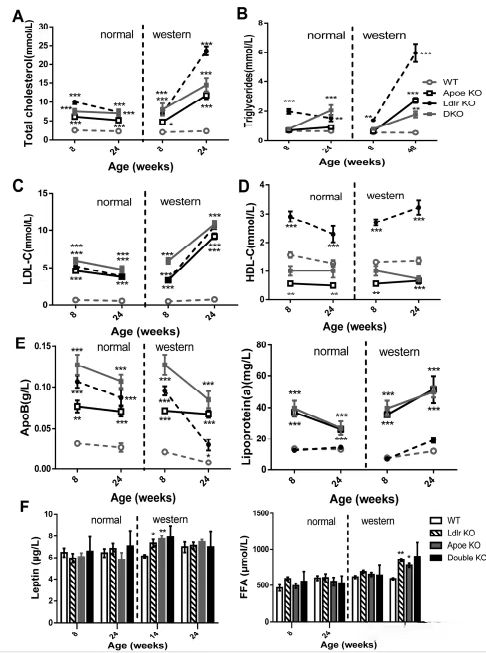
(血清中的脂质和脂蛋白的分布)
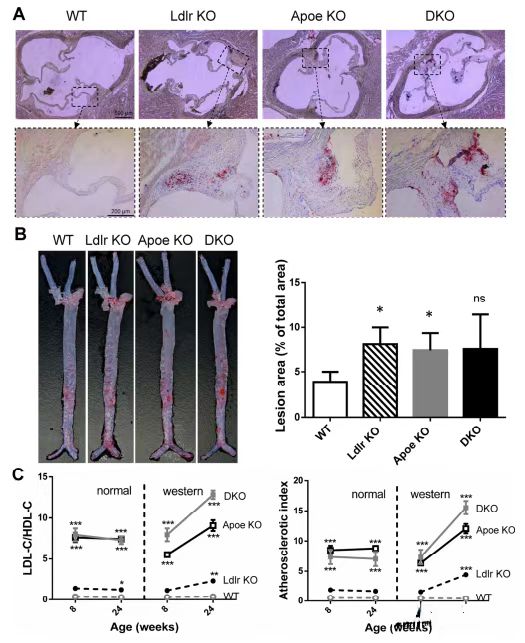
(正常饮食喂养突变大鼠的动脉粥样硬化特征)
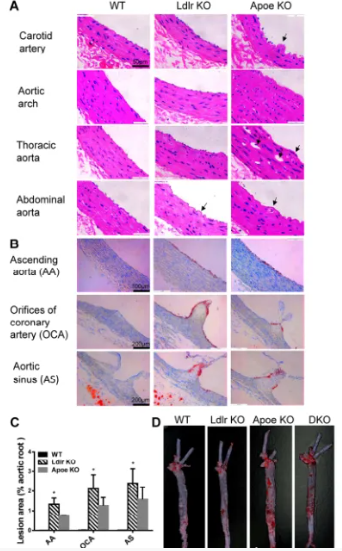
(西方饮食喂养大鼠的代表性动脉粥样硬化结果)
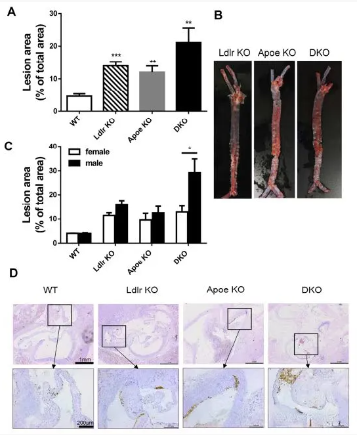
(西方饮食喂养的 72 周龄大鼠主动脉严重动脉粥样硬化和巨噬细胞积聚)
更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务~