公司资讯
胃癌动物模型的构建
发布日期:2024-07-24

胃癌动物模型的构建
胃癌作为世界四大高发恶性肿瘤之一,其高发病率与致死率令人瞩目。其病因复杂,转移与浸润机制不明,显著影响治疗策略与生存质量。构建精准模拟人体胃癌进程的动物模型,对于深入理解疾病机理、优化治疗方案及加速药物与基因治疗研发至关重要。这一模型将成为探索胃癌根源、筛选有效药物及创新治疗策略的强大工具。
一、实验动物的选择
在构建胃癌模型时,动物选择多样,包括非人灵长类、犬、兔等,但考虑到成本效益、饲养便捷性及诱发效率,大鼠、小鼠及裸鼠成为主流。选择时需谨慎,因动物性别、品系及个体对致癌物质的敏感性差异显著,这直接影响模型效果。因此,实验设计需综合考量实验目标、预算限制等因素,以精准选定最适合的造模动物。
二、常见胃癌动物模型
1.诱导模型
包括化学诱癌剂,幽门螺杆菌(H.pylori) ,化学诱癌剂联合H.pylori等。
1.1 化学诱癌剂
亚硝基化合物是胃癌重要诱因,常用MNNG、MNU等作为诱导剂,模拟胃癌发生,助力胃癌研究与防治策略的制定。
相较于高剂量组(83μg/ml)的50%成模率,低剂量组(33μg/ml)同样达到了50%的成模率,显示出在低浓度下,诱导剂的效果并未如预期般随着剂量的增加而增强。
- 优点:诱癌简便高效,模型机制近似于人胃癌自然过程,是研究胃癌的理想动物模型。
- 缺点:诱导耗时较长,不适用于短期及大规模批量实验,限制其应用灵活性。
- 应用:评估抗肿瘤药、中成药对MNNG诱导胃癌模型的防护与治疗效果
1.2 幽门螺杆菌(HP)感染
小鼠在感染H.pylori SS1菌种8个月后,显现出胃炎和胃萎缩迹象;若持续诱导至2年,则能观察到胃癌的部分典型病理特征。
评价:H.pylori可模拟慢性胃病过程,但需长时间诱导且转移难,其应用受限于资源稀缺及严格操作要求,影响了模型在广泛研究中的推广使用。
1.3 最常用的诱导模型:H.pylori联合诱癌剂
鉴于H.pylori诱导胃癌效率低且耗时,现已少用。目前,H.pylori联合诱癌剂如MNU或H.felis更受青睐,前者联合12周诱变率显著提升,后者则几乎达100%诱导率。
- 优点:模拟胃癌进程逼真,同时便于全程评估实验动物的整体与局部状况。
- 缺点:相较于异种种植,其诱导周期长,不适合大批量实验的快速推进。
- 应用:研究胃癌的病因学与生物学行为。
2.种植模型
构建胃癌动物模型时,瘤源为胃癌细胞悬液或瘤组织块。
2.1 原位移植法
胃癌细胞悬液接种法是一种实验技术,涉及将胃癌细胞与胶原复合物混合后,精准地注射到实验动物(如小鼠)的胃大弯区域,紧邻胃窦处的浆膜下层,以此模拟胃癌的原位发生环境,为后续研究胃癌的生长、侵袭及转移等生物学行为提供实验基础。
2.2 瘤组织块移植法
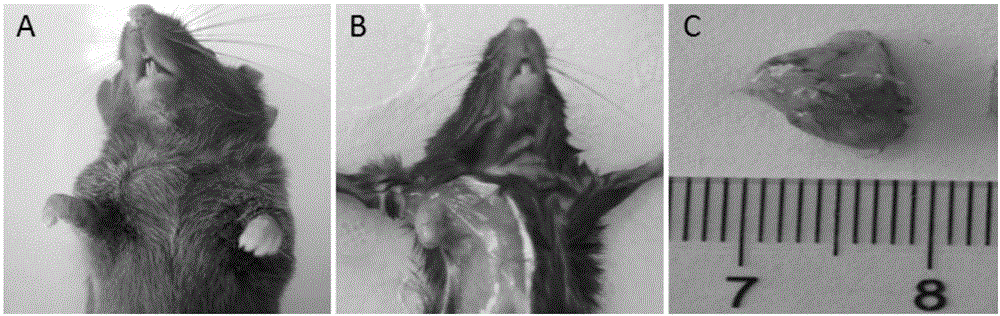
使用医用胶将瘤组织块固定于胃壁,约12周可成瘤。实验显示,相比胃癌细胞悬液接种,瘤组织块原位移植法成瘤速度更快,为研究胃癌提供了更高效的模型构建方法。
原位移植法与瘤组织块移植法的比较:胃癌细胞悬液接种虽能模拟胃癌,但成瘤与转移效率逊于瘤组织块移植法。后者全面模拟胃癌进程,操作简便高效,经济成本低,且成瘤周期短,成瘤与转移率高,是研究胃癌生长、侵袭及转移机制的理想模型。
应用:研究胃癌生物学行为、对新型抗肿瘤药物进行筛选、评价分子靶向药物的疗效等。
2.3 异位移植法
移植部位选定裸鼠腋下,为模拟晚期胃癌转移,还可在腹腔内注入胃癌细胞悬液或瘤组织块,以全面再现胃癌生物学特性,为深入研究胃癌转移机制提供可靠实验平台。
优点:异位移植法以其简便步骤和高效成瘤率(通常1-4周)脱颖而出,优于诱导法与原位移植法,特别适用于需要快速结果的短期实验研究,为胃癌及其他肿瘤研究提供了便捷途径。
三、基因工程鼠
涉及多种转基因或基因敲除小鼠模型,如INS-GAS小鼠模拟胰岛素与胃泌素相互作用,TFF-1、胃泌素基因敲除小鼠研究特定基因缺失效应,Wntl、K-ras及COX-2转基因小鼠则用于探索特定基因过表达对胃癌发生的影响。
四、总结

构建精准的胃癌实验动物模型是医学研究的基石,各类模型各具特色。诱导模型虽能模拟胃癌自然进程,但周期长、成瘤率有限;种植模型则快速高效,却受裸鼠免疫缺陷影响,限制了对转移机制的深入探究。新兴基因工程小鼠模型虽能精确调控基因表达,但因成本高、单基因操作局限,难以全面反映胃癌多基因作用。尽管面临挑战,但随着科技进步,胃癌实验动物模型将更加完善,为揭示胃癌发生转移机制及药物研发提供有力支持。