公司资讯
小鼠常用的注射给药方法(二)
发布日期:2024-10-29
小鼠常用的注射给药方法(二)
一、尾静脉注射
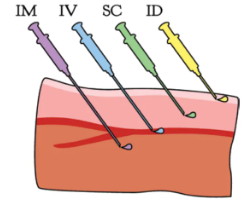
1.尾静脉注射的重要性
尾静脉注射能够使药物直接进入动物的血液循环系统,避免了口服给药时的首过代谢效应,从而提高了药物的生物利用率。此外,静脉注射还可以精确控制给药剂量和时间,为实验结果的准确性和可靠性提供了有力保障。
2.尾静脉的解剖特点
大小鼠的尾静脉共有3条,其中尾部左右两侧各有一条,背侧有一条。由于左右两侧静脉的角质层较薄且易于固定,因此在实际操作中,这两条静脉常被作为注射的首选。
3. 具体操作步骤
(1)保定与暴露:
使用专门的保定器将小鼠保定,使其尾部充分暴露。
(2)血管扩张:
用45-50℃的温水浸润尾部半分钟或用酒精擦拭,以扩张血管并使表皮角质软化。
(3)持针与进针:
右手持注射器,使针头与静脉平行(小于30°),在距鼠尾尖1/4处(约2-3厘米)进针。此处皮薄易于刺入。
(4)药物注射:
先缓注少量药液,如无阻力且无白色皮丘出现,则表示针头已进入静脉,可正式注入药物。
(5)止血与观察:
注射完毕后,用干棉球按压止血,并观察血管颜色变化以确认注射成功。
4.注意事项
(1)注射位置的选择:
如遇到阻力较大或注射时有隆起,则说明可能注射到了皮下。此时应迅速抽出注射器,并在原注射位点稍上的位置再次尝试。同时,注射开始时应尽可能靠近尾尖(远心端),以便在第一次注射失败后仍有未受损的静脉可用。
(2)血管充盈的保障:
静脉血管的充盈程度是影响注射成功率的关键因素。因此,在注射前应确保血管充盈。一般可通过酒精擦拭等方法来促进血管扩张。
(3)插入深度的控制:
由于小鼠尾静脉很浅,插入深度不宜过深。否则可能刺穿血管壁导致注射失败或药物外渗。
(4)注射剂量的控制:
小鼠和大鼠的单次注射量应分别控制在0.10.2ml/10g和0.30.5ml/100g的范围内。过量注射可能导致动物死亡或实验结果不准确。
二、腹腔注射
1.腹腔注射的应用场景
腹腔注射常用于小鼠麻醉、药物诱导等实验,也适用于不适宜或经胃肠道吸收效率较低的给药情况。此外,对于幼鼠或体重较小的实验动物,腹腔注射也是一种有效的给药方式。
2.腹腔注射的操作步骤
(1)保定动物:
左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,翻转小鼠使小鼠的头部向下,腹部向上。这样由于重力作用,腹腔中的器官会自然倒向胸部,减少损伤大肠、小肠等器官的风险。
(2)进针:
右手持注射器,将注射针头于左下腹部刺入皮下,然后以45度角穿过腹肌。进针时不能太深,感到明显的穿透感即可,以防刺入脏器。进针后注意回抽,如果抽回较吃力且仅空气被回吸,则说明进针成功。
(3)注射药物:
固定针头,缓缓注入药液。进针的动作要轻柔,防止刺伤腹部器官。
(4)停留与拔出针头:
注射完后不能立马抽出针头,应将针头在腹腔内多停留一段时间,堵住伤口阻止药物外流。随后缓缓拔出针头,并轻微旋转针头以防止漏液。
3.腹腔注射的注意事项
(1)避免刺伤内脏:
针头刺破腹肌后会有落空感,此时针头已进入腹腔,应停止进针以免针头刺入过深损伤内脏。
(2)保持动物头低位:
为使内脏移向上腹,应使动物处于头低位,这样可以进一步减少损伤内脏的风险。
(3)防止漏液:
对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔。注射完药物后,缓缓拔出针头,并轻微旋转针头以防止漏液。
(4)控制注射剂量:
大鼠单次注射量一般为1.02.0ml/100g,小鼠单次注射量一般为0.10.2ml/10g。过量注射可能导致动物死亡或实验结果不准确。
4.腹腔注射与尾静脉注射的比较
腹腔注射与尾静脉注射各有优缺点。尾静脉注射对初学者来说可能有一定难度,但注射是否成功容易判断,不会对实验结果造成影响。而腹腔注射虽然看似简单,但如果操作不当,很容易造成注射失败且不易被发现,从而直接影响到实验结果。因此,在进行腹腔注射时,操作者需要更加谨慎和细心。
文中部分文字,来源于网络,版权仍归原作者所有。
如有侵权,烦请告知,谢谢!
更多服务咨询请致电:
15001394959
15555144551
17666664644
竭诚为您服务