公司资讯
基于 NLRP3 / Caspase-1 / GSDMD 焦亡通路探索小鼠急性肺损伤动态时间模型的建立
发布日期:2024-06-20

基于 NLRP3 / Caspase-1 / GSDMD 焦亡通路探索小鼠急性肺损伤动态时间模型的建立
急性肺损伤(ALI)及其严重形式急性呼吸窘迫综合征(ARDS)是临床中极为严重的呼吸系统疾病,尤其在脓毒症和COVID-19等疾病中表现尤为致命。由于发病机制复杂且难以精确治疗,建立一个能高度模拟人类ALI发病过程的动物模型对于疾病研究至关重要。目前,脂多糖(LPS)诱导的鼠类模型因其高成功率、可重复性和低成本成为首xuan。ALI涉及肺部炎症反应的过度激huo,而NLRP3/Caspase-1/GSDMD介导的细胞焦亡在这一过程中扮演关键角色。因此,研究这一信号通路对于理解ALI的发病机制及开发新疗法具有重要意义。
本篇介绍的实验研究采用小鼠为实验动物,使用气管滴注的无创性操作进行 LPS 诱导 ALI 模型,直接对肺造成损伤,并检测不同时间节点下小鼠肺部损伤程度与焦亡通路相关蛋白表达情况,以探索焦亡机制下 ALI 造模的最适时间条件,同时挖掘 ALI 模型下焦亡的时间动态变化规律。
1、材料
1.1 动物
选用54只SPF级雄性BALB/c小鼠,年龄6至8周,体重在16至20克之间【均来自斯贝福(北京)生物技术有限公司】。这些小鼠在恒温(24±2℃)、恒湿(55%±5%)且光照与黑暗交替的环境中饲养,食物和水供应充足。经过3天的适应性喂养后,安置在中研子创(北京)生物科技有限公司的SPF级屏障环境中,确保实验条件的标准和稳定。
1.2 主要试剂与仪器
本研究采用来自美国Sigma公司的E. coli O55:B5脂多糖(批号0000135216)、北京化学试剂公司的戊巴比妥钠(批号020402)等试剂。此外,还使用了红细胞裂解液、RIPA裂解液、BCA试剂盒、多种特异性抗体及ELISA试剂盒。实验设备包括手术器械、细胞计数仪、显微镜、酶标检测仪、离心机及蛋白质凝胶成像系统,确保实验结果的准确性和可靠性。
2、实验方法
2.1 动物分组与 ALI 动态时间模型构建
本研究中,54只健康雄性BALB/c小鼠被随机分配至9组,包括对照组(Con组)和接受LPS滴鼻处理的8个时间组(1、3、6、12、18、24、48和72小时)。除对照组外,其余组别在LPS滴鼻(1 mg/kg)后的不同时间点进行取材。LPS溶液浓度为0.4 mg/mL,通过左侧鼻孔滴入,并在滴入后迅速将小鼠直立。随后,在相应时间间隔内对各组小鼠进行取材和检测。
2.2 肺组织大体改变、病理观察及病理评分
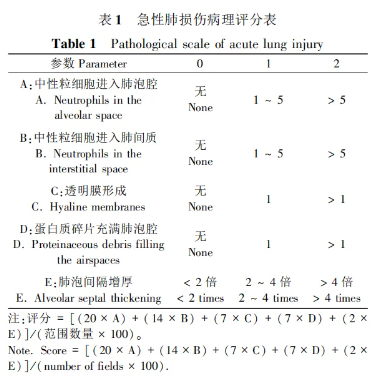
LPS 造模后,各组小鼠分别在不同时间点使用0. 6%戊巴比妥钠溶液(0. 1 mL / 10 g) 腹腔注射麻醉,并呈仰卧位固定,腹主动脉放血处死后,打开胸腔,取出全肺组织,通过肉眼观察全肺组织大体的损伤情况。 取新鲜右肺上叶,在预冷的 PBS 中排出残留血液,置于 4%多聚甲醛固定 48 h 后,进行梯度脱水、包埋、切片、脱蜡入水、苏木精-伊红( HE) 染色、脱水、封片等,处理后将染色完成的切片在光学显微镜下观察并评价肺损伤情况。 评价指标采用2011 年美国胸科医师协会官方发布的实验动物急性肺损伤的病理评分系统[7],每个标本在 10 个随机400 × 高倍镜视野下观察,最后根据各项结果进行加权计算后得出半定量肺损伤评分。
2.3 肺指数计算、肺含水量及肺组织湿/干重比(W/D)测定
在取材前,首先称取小鼠体重并记录。随后,小鼠经0.6%戊巴比妥钠溶液(0.1 mL/10 g)腹腔注射麻醉,并固定于仰卧位。经腹主动脉放血后,开胸腔取全肺组织,用预冷PBS漂洗并去除多余水分后称重。肺指数通过全肺湿重与小鼠体重的百分比来计算。
对于肺含水量和湿/干重比的测定,选择左肺冲洗干净并吸干水分后称重为湿重,随后置于60℃烘箱中烘干48小时至重量恒定,记录为干重。右肺中下叶则用于另一组测定,同样漂洗并吸干水分后称重为湿重,并在相同条件下烘干至恒重后称取干重。最后,根据湿重和干重计算肺含水量及湿/干重比。
肺指数按照以下公式计算:
肺指数 = 全肺组织湿重/ 小鼠体重 × 100%
按照以下公式计算肺含水量及湿/ 干重比:
肺含水量(%) = (W-D) / W × 100%;
肺湿/干重比(%) = W/ D × 100%
2.4 肺泡灌洗液白细胞计数及蛋白浓度定量
小鼠接受0.3%戊巴比妥钠溶液(0.1 mL/10 g)腹腔注射以麻醉,随后仰卧位固定,通过腹主动脉放血处死。接着,胸腔被打开以充分暴露气管,用棉线结扎右支气管。之后,利用1 mL注射器通过主支气管注入预冷的PBS(0.8 mL),并反复灌洗4次,收集得到的肺泡灌洗液(BALF)以备后续分析。BALF在充分涡旋混匀后,吸取20 μL,并加入40 μL红细胞裂解液以裂解红细胞,然后检测白细胞总数。剩余的BALF在4℃、3000 r/min的条件下离心10分钟,取上清液,利用BCA蛋白浓度试剂盒检测BALF中的蛋白浓度。
2.5 肺泡灌洗液炎症因子测定
取小鼠 BALF 上清液,按照 ELISA 试剂盒检测方法,检测炎症因子TNF-α、IL-6、IL-1β、IL-18含量,使用酶标仪在450 nm波长处检测吸光度,根据标准曲线计算炎症因子含量并记录。
2.6 肺组织焦亡通路相关蛋白检测
通过Western Blot检测肺组织中NLRP3、pro-Caspase-1、Caspase-1和GSDMD蛋白表达。取50mg肺组织,加入RIPA裂解液匀浆后冰上裂解。离心取上清,BCA法测蛋白浓度。变性后电泳,湿法转膜,5% BSA封闭。与相应抗体孵育后,TBST洗涤,加二抗孵育。最后,ECL发光液显影,使用Image J分析灰度值,量化蛋白表达。
3、结果
3.1小鼠体重变化与整体状态改变
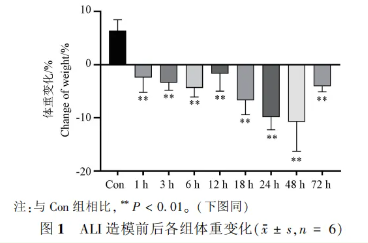
在适应性喂养、ALI造模和取材前,各组小鼠的体重均被仔细记录。对比造模前后的体重变化,可以发现LPS造模后小鼠体重普遍降低,尤以24小时和48小时组最为显著(见图1)。对照组小鼠表现健康活跃,反应灵敏;而LPS造模组小鼠则出现精神不振、饮食减少、体重降低等迹象,尽管未出现死亡,但状态明显不如对照组,这些观察结果进一步验证了LPS造模对小鼠体重和整体健康的影响。
3.2 肺组织大体观察、病理学观察及半定量评分
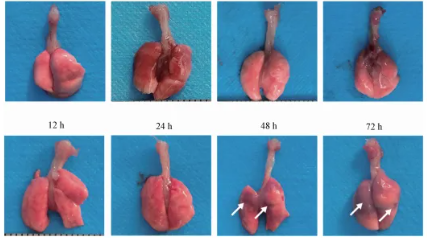
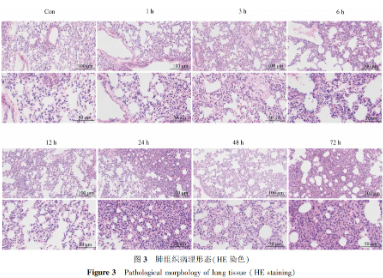
肺组织观察结果显示,1至24小时内未见显著的急性损伤迹象。然而,至48小时时,出现显著的大面积损伤,肺组织呈肝样变并伴有出血,病灶从肺门部向周围扩展,覆盖约40%至50%的总肺面积,且双肺均受影响。随时间推移至72小时,肺组织损伤加剧,左肺病变面积显著增至60%至70%,而右肺约为20%至30%。
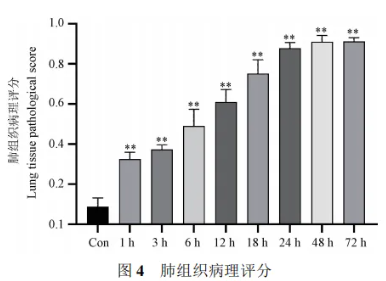
HE染色显示,Con组小鼠肺组织正常;LPS刺激后,肺组织出现急性损伤,表现为红细胞渗出、肺泡充血水肿、间隔增厚、出血灶、结构塌陷及炎性细胞浸润,尤其在24至72小时损伤严重。病理评分证实,造模后肺组织损伤随时间加剧,与Con组对比差异显著。
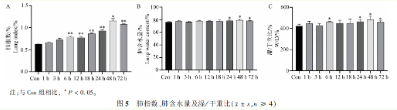
3.3 肺指数、肺含水量与肺组织湿干重比
肺指数统计显示,LPS造模后6小时起肺指数显著上升,且6至72小时均较对照组有显著差异。肺含水量及湿/干重比测定亦表明,24至72小时肺组织含水量及湿/干重比显著增加,与对照组相比具有统计学意义。
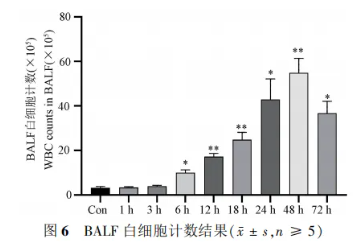
3.4 肺泡灌洗液白细胞计数
经过对BALF的处理和分析,利用Count Star白细胞计数仪发现,白细胞数量在LPS造模后6小时即开始上升,并持续升高至48小时,这些变化与Con组相比均显著。尽管在72小时后白细胞数量略有下降,但仍与Con组存在统计学差异。
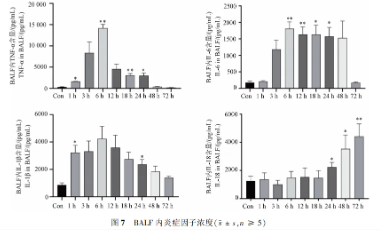
3.5 肺泡灌洗液炎症因子
实验结果揭示,炎症因子TNF-α、IL-1β、IL-6和IL-18随时间变化呈现先升后降趋势。TNF-α、IL-1β在1小时后显著升高,IL-6有升高趋势但尚未显著。IL-18在24小时后显著升高并持续至72小时。这些炎症因子在24小时时均显著升高,而48小时后除IL-18外均明显下降。
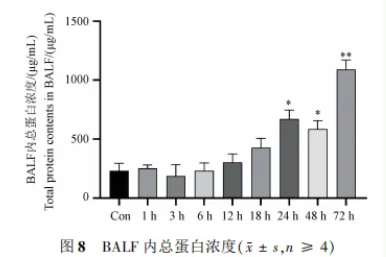
3.6 肺泡灌洗液内总蛋白浓度
与 Con 组相比,LPS 造模 24 h 后 BALF 内蛋白浓度有显著上升,由图 8 所示结果可知,造模后24 ~ 72 h 蛋白浓度均有明显上升,24、48 及 72 h 与Con 组相比,均具有显著性差异,其中以 72 h 达到最gao水平。
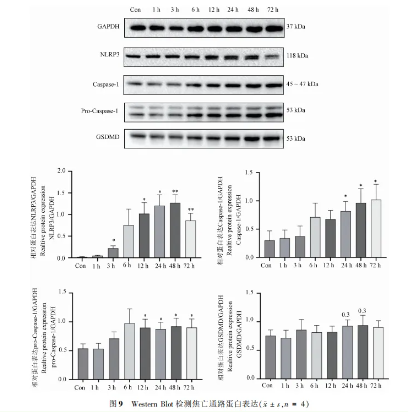
3.7 焦亡通路相关蛋白表达
Western Blot分析显示,ALI模型各时间组焦亡通路蛋白NLRP3、pro-Caspase-1、Caspase-1和GSDMD表达均上调,表明ALI激huo了焦亡通路。特别是24至72小时组,这些蛋白表达显著增强,与Con组相比具有统计学差异,提示这些时间点为关键病理过程。
4、讨论
ALI/ARDS是多种肺部疾病的急性严重并发症,其发病机制复杂,与CSS、免疫细胞激huo和炎症因子大量释放有关。SARS-CoV-2等病毒可通过ACE2受体入侵肺部,引发免疫激huo和炎症级联反应。细胞焦亡作为程序性细胞死亡方式,在ALI/ARDS中扮演重要角色,尤其是肺泡巨噬细胞。GSDMs蛋白家族和Caspase酶是焦亡的关键参与者,参与炎性小体的生成和炎症因子的释放。抑制细胞焦亡可能为ALI/ARDS提供新的治疗策略。
LPS诱导的ALI模型中,该通路相关蛋白表达上调,与肺损伤程度和炎症因子分泌增加密切相关。实验结果显示,24~48小时为焦亡通路表达最明显的时间段,肺损伤最为严重。这提示细胞焦亡是ALI发生 fa展的重要机制,并提示24~48小时为研究ALI具体机制及干预靶点的关键时间点。
参考文献:
樊懿萱,王心威,李军梅,等. 基于 NLRP3 / Caspase-1/ GSDMD 焦亡通路探索小鼠急性肺损伤动态时间模型的建立 [J]. 中国实验动物学报, 2024, 32(4): 423-434.
---- END ----
更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务~